Blog
Blog
Tiêu chuẩn của kho bảo quản vắc-xin (bao gồm cả vắc-xin Covid-19)
Cách bảo quản và vận chuyển vắc-xin không đúng thì chất lượng vắc-xin sẽ không đảm bảo, dẫn đến khả năng sinh kháng thể để phòng bệnh sẽ bị giảm, thậm chí gây tai biến. Chính vì vậy, các cơ sở cần tuân thủ nghiêm ngặt những yêu cầu về kho bảo quản vắc xin như: nhiệt độ, cách bảo quản và sử dụng, tủ lạnh bảo quản. Tuy nhiên thực hành tốt bảo quản vắc xin có các tiêu chuẩn đáp ứng riêng cho từng loại cơ sở. Chi tiết từng tiêu chuẩn theo dõi tại bài viết của GMP Groups dưới đây.

Kho lạnh bảo quản vắc xin
Kho GSP của cơ sở xuất nhập khẩu vắc xin
Các cơ sở xuất nhập khẩu vắc xin được áp dụng theo phụ lục I thông tư 36/2018 về tổ chức quản lý, nhân sự, hệ thống chất lượng, nhà xưởng trang thiết bị, bảo quản, nhập hàng, xuất hàng, quy trình và hồ sơ tài liệu, hàng trả về và sản phẩm bị thu hồi và tự thanh tra.
Các yêu cầu của kho GSP bao gồm:
Tổ chức quản lý:
Cơ sở có cơ cấu tổ chức đầy đủ thể hiện bằng sơ đồ tổ chức. Bản mô tả công việc rõ ràng. Người phụ trách chuyên môn có trình độ và kinh nghiệm phù hợp.
Nhân sự:
– Có trình độ kinh nghiệm phù hợp;
– Được đào tạo ban đầu và định kỳ về GSP và nghiệp vụ bảo quản phù hợp
– Được đào tạo về vệ sinh cá nhân và vệ sinh chung.
– Được kiểm tra sức khỏe định kỳ
– Được trang bị bảo hộ lao động phù hợp
Hệ thống chất lượng
– Có văn bản quy định chính sách chất lượng và được phê duyệt.
– Phải thiết lập một hệ thống chất lượng khi thi công phòng sạch nhằm đảm bảo đáp ứng các yêu cầu chất lượng đề ra.
– Phải có quy định về việc phát hiện vắc xin giả, nghi ngờ giả, kém chất lượng. Có khu vực bảo quản riêng với Vắc xin biệt trữ, đảm bảo an ninh.
– Phải có quy định đánh giá nhà cung cấp, phân phối và đảm bảo khả năng truy nguyên nguồn gốc của vắc xin, mỗi loại vắc xin luôn có hồ sơ kèm theo.
Nhà xưởng, trang thiết bị
– Xây dựng nơi cao ráo, an toàn, tránh ảnh hưởng bất lợi của thời tiết, động vật gây hại.
– Diện tích kho đủ rộng để bố trí các khu vực cho hoạt động bảo quản theo quy định: (khu vực xuất nhập, bảo quản, biệt trữ, chờ xử lý, dán nhãn….)
– Khu vực bảo quản có biển hiệu rõ ràng, dễ vệ sinh.
– Phương tiện bảo quản phù hợp và được hiệu chuẩn và bảo dưỡng định kỳ (nhiệt ẩm kế, chỉ thị đông băng, thùng chuyên dụng bảo quản vắc xin…)
– Có hệ thống ghi và cảnh báo nhiệt độ kho lạnh (đèn, chuông/tin nhắn) kịp thời khi có sự cố. Nhiệt độ được ghi lại tự động liên tục trong suốt thời gian bảo quản.
– Có hệ thống máy tính kết nối internet và thực hiện quản lý vắc xin, sinh phẩm bằng phần mềm vi tính.
Bảo quản:
– Vắc xin, sinh phẩm phải được cấp phát theo nguyên tắc: FIFO (nhập trước xuất trước) FEFO (hết hạn trước xuất trước)
– Vắc xin, sinh phẩm biệt trữ: phải cách ly vật lý giữa các khu vực và có biển hiệu rõ ràng. Hàng hỏng vỡ phải nhanh chóng thu gom và tách riêng khỏi khu vực bảo quản.
– Nhiệt độ bảo quản Vắc xin, sinh phẩm: 2 đến 80C. Các loại VX, SP được sắp xếp hợp lý tránh tình trạng đông băng với một số loại vắc xin dễ hỏng do đông băng.
– Phải định kỳ đối chiếu hàng hóa thực tế và sổ sách. Tránh cấp phát hàng hết hạn.
– Các điều kiện bảo quản được kiểm tra tối thiểu 2 lần/ngày. Mỗi kho/khu vực phải có ít nhất 1 thiết bị theo dõi nhiệt độ tự động, được đặt ở vị trí có khả năng dao động nhiều nhất được xác định dựa trên kết quả đánh giá độ đồng đều nhiệt độ kho.
Nhập hàng:
– Cần kiểm tra nhiệt độ của vắc xin, sinh phẩm trong quá trình vận chuyển trước khi nhập.
– Cần kiểm tra chứng từ mua hàng, chất lượng cảm quan về tính đồng nhất của vắc xin, sinh phẩm.
– Các thùng thuốc không nguyên vẹn, hư hại, mất niêm phong không được nhập kho. Phải được bảo quản ở khu vực biệt trữ riêng nếu không được hủy bỏ ngay.
– Các hoạt động nhập hàng phải được ghi chép lại.
Xuất hàng:
– Chỉ xuất hàng khi có lệnh xuất hàng. Đối với vắc xin đang trong quá trình biệt trữ, phải được người chịu trách nhiệm về chất lượng cho phép mới được xuất kho.
– Khi sử dụng đá khô, không để đá khô tiếp xúc trực tiếp với vắc xin.
Quy trình và hồ sơ tài liệu:
– Các quy trình phải được soạn thảo, hoàn thiện, rà soát và phê duyệt, không được thay đổi khi chưa được phép.
– Phải có các quy trình thao tác chuẩn đối với tất cả các hoạt động trong khu vực bảo quản , kể cả việc xử lý hàng hết hạn.
– Phải có hồ sơ ghi chép đối với tất cả các hoạt động trong khu vực bảo quản, kể cả việc xử lý hàng hết hạn.
Hàng trả về và sản phẩm bị thu hồi
– Phải có quy trình xử lý vắc xin trả về và thu hồi.
– Các vắc xin phải được bảo quản đúng điều kiện nhiệt độ trong khu vực biệt trữ, đảm bảo an ninh.
– Tất cả các thuốc thu hồi không đạt chất lượng phải được xử lý theo quy định Pháp luật.
– Toàn bộ lô vắc xin trả về hoặc thu hồi đề được ghi chép hồ sơ đầy đủ.
Tự thanh tra:
– Hoạt động được thực hiện bởi người có chuyên môn và theo kế hoạch, thực hiện một cách độc lập và chị tiết.
– Kết quả tự thanh tra được ghi chép lại. lập thành biên bản tự thanh tra.
– Chương trình hành đồng khắc phục: Báo cáo khắc phục cần được lãnh đạo phê duyệt.
Kho GSP cơ sở bảo quản vắc xin tuyến trung ương
Kho GSP cơ sở bảo quản vắc xin tuyến trung ương áp dụng theo các nguyên tắc của phụ lục III thông tư 36. Các nguyên tắc giống với Kho GSP Xuất nhập khẩu. Tuy nhiên đối với phần “Xuất hàng và vận chuyển” thì các cơ sở có quyền nhập khẩu thuốc, nguyên liệu làm thuốc nhưng không được thực hiện quyền phân phối. Chỉ được xuất hàng và giao hàng cho cơ sở có chức năng bán buôn thuốc, nguyên liệu làm thuốc tại kho bảo quản thuốc, nguyên liệu làm thuốc của cơ sở. Không được thực hiện việc vận chuyển thuốc, nguyên liệu làm thuốc trừ vận chuyển từ kho hải quan về kho của cơ sở hoặc giữa các kho của cơ sở.
Kho GSP cơ sở khám chữa bệnh, bảo quản vắc xin chương trình tiêm chủng mở rộng tuyến huyện
Áp dụng nguyên tắc phụ lục IV thông tư 36. Các điểm khác so với các tiêu chuẩn kho GSP cơ sở bảo quản tuyến Trung ương như sau:
Nhân sự:
Không cần phụ trách chuyên môn, thủ kho có trình độ tối thiểu dược sĩ trung học, hiểu biết về dược và nghiệp vụ bảo quản.

Trang thiết bị nhà xưởng:
Nhà kho diện tích đủ rộng để bố trí các khu vực cho các hoạt động: (Khu vực bố trí ít hơn kho GSP phụ lục I, III)
– Tiếp nhập kiểm nhập;
– Bảo quản thuốc theo yêu cầu bảo quản đặc biệt;
– Bảo quản thuốc kiểm soát đặc biệt
– Biệt trữ chờ xử lý;
– Chuẩn bị, đóng gói và cấp phát.
Kho thường không yêu cầu có ít nhất 01 thiết bị theo dõi nhiệt độ tự ghi dữ liệu. Chỉ yêu cầu có ít nhất 01 thiết bị theo dõi nhiệt độ tư ghi. Trong kho/tủ lạnh yêu cầu có kiểm soát về nhiệt độ, độ ẩm được cài đặt tần suất ghi 1-2 lần/giờ. Phải có phương tiện phát hiện và cảnh báo (chuông, đèn, tin nhắn..) kịp thời về sự cố sai lệch về điều kiện bảo quản.
Quy trình hồ sơ tài liệu
Phải có tối thiểu 12 quy trình và các hồ sơ ghi chép cho các hoạt động của kho:
– Quy trình nhập thuốc và kiểm tra thuốc nhập kho
– Quy trình bảo quản thuốc trong kho
– Quy trình kiểm tra, theo dõi chất lượng thuốc trong kho
– Quy trình vệ sinh kho
– Quy trình kiểm tra, bảo trì, bảo dưỡng thiết bị bảo quản
– Quy trình kiểm soát mối, mọt, côn trùng, các loài gặm nhấm trong kho
– Quy trình xử lý thuốc bị hư hỏng, đổ vỡ
– Quy trình theo dõi, ghi chép điều kiện bảo quản
– Quy trình cấp phát
– Quy trình tiếp nhận và xử lý thuốc trả về
– Quy trình biệt trữ
– Quy trình định kỳ đối chiếu thuốc trong kho.
Không bắt buộc mà khuyến khích sử dụng phần mềm vi tính để quản lý hoạt động bảo quản, cung ứng thuốc.
GMP Groups – đơn vị cung cấp dịch vụ tư vấn kho bảo quản vắc xin tiêu chuẩn GSP trọn gói
Với kinh nghiệm dày dặn và đội ngũ chuyên nghiệp, GMP Groups tự tin mang đến cho khách hàng Giải pháp tư vấn toàn diện xây dựng và vận hành Kho bảo quản tiêu chuẩn GSP bao gồm:
Tư vấn, thiết kế nhà xưởng, hệ thống phụ trợ kho bảo quản tiêu chuẩn GSP.
GMP Groups với đội ngũ nhân sự có nhiều năm hoạt động trong các công ty dược phẩm, được tiếp xúc và huấn luyện thường xuyên trong môi trường thực hành tốt (GMP, GSP, GLP). Bên cạnh đó, đội ngũ thiết kế nhiều năm kinh nghiệm trong lĩnh vực thiết kế phòng sạch – kho bảo quản dược phẩm đảm bảo sẽ tư vấn và thiết kế cho khách hàng một cách hợp lý nhất hài hòa giữa yêu cầu khách hàng và tiêu chuẩn GSP.
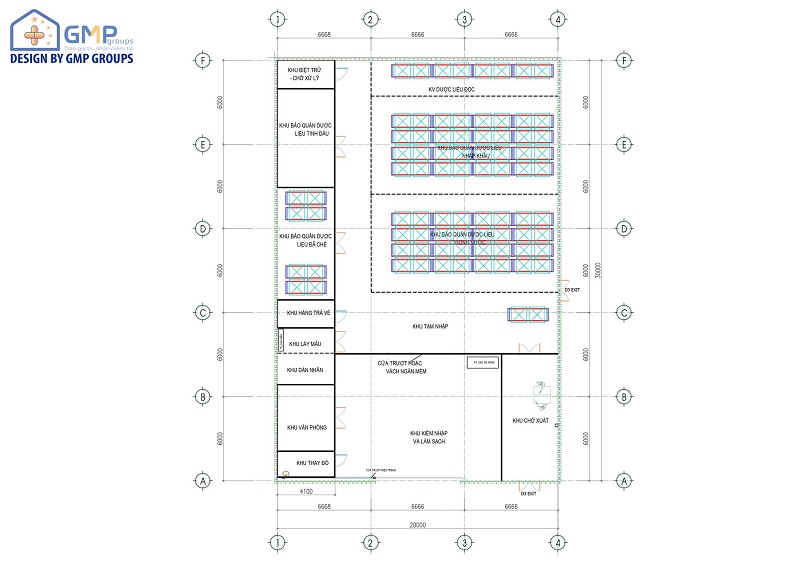
Bản vẽ thiết kế Kho bảo quản dược liệu phục vụ xuất khẩu
Thi công nhà xưởng, hệ thống phụ trợ kho bảo quản tiêu chuẩn GSP
GMP Groups chuyên thực hiện các dự án xây dựng nhà máy dược phẩm, TPBVSK. Trong đó bao gồm cả các kho bảo quản đạt tiêu chuẩn GSP. GMP Groups cam kết đảm bảo chất lượng thi công, tiến độ thi công với tinh thần trách nhiệm cao nhất.
Dịch vụ thiết lập hệ thống hồ sơ tài liệu, quy trình thao tác chuẩn
GMP Groups cung cấp cho khách hàng bộ quy trình, hồ sơ tài liệu hợp lý và đầy đủ nhất. Qua đó khách hàng hiểu rõ về hệ thống quy trình, hồ sơ tài liệu cho kho bảo quản tiêu chuẩn GSP.
Dịch vụ chuẩn bị hồ sơ đề nghị cấp giấy chứng nhận GSP
GMP Groups sẽ hỗ trợ khách hàng trong việc chuẩn bị hồ sơ đề nghị cấp giấy chứng nhận GSP. Chúng tôi theo dõi và giúp khách hàng bổ sung các tài liệu khi cần thiết.
GMP Groups cam kết đảm bảo giúp khách hàng có được giấy chứng nhận đạt tiêu chuẩn GSP. Chúng tôi hỗ trợ khách hàng khắc phục các tồn đọng sau mỗi đợt thanh tra, bảo dưỡng nhà xưởng trong quá trình hoạt động sản xuất, cải tạo lại nhà xưởng theo yêu cầu của khách hàng.
Mọi thông tin chi tiết về Tư Vấn – Đào Tạo – Hướng Dẫn Áp Dụng GSP vui lòng liên hệ:
Công ty Cổ phần GMP Groups
Trụ sở: Lô LK20.8, KĐT Sinh thái Ecoriver, phường Hải Tân, thành phố Hải Dương, tỉnh Hải Dương
Hotline/zalo: 0945.255.457 – 0917.885.786
Website: gmpgroups.com.vn
Email: info@gmpgroups.com.vn
Tiêu điểm trong ngày



