Quy trình thủ tục và bộ hồ sơ tiêu chuẩn GMP mới nhất 2023
Tiêu chuẩn GMP là điều kiện bắt buộc để các nhà máy dược phẩm, thực phẩm, mỹ phẩm, thiết bị y tế được tiếp tục sản xuất cũng như khẳng định chất lượng và uy tín. Vì vậy rất nhiều cơ sở sản xuất có nhu cầu đăng ký giấy chứng nhận GMP. Vậy quy trình thủ tục xin cấp giấy chứng nhận GMP như thế nào? Bộ hồ sơ tiêu chuẩn GMP bao gồm những gì? Hãy cùng GMP Groups tìm hiểu qua bài viết dưới đây.
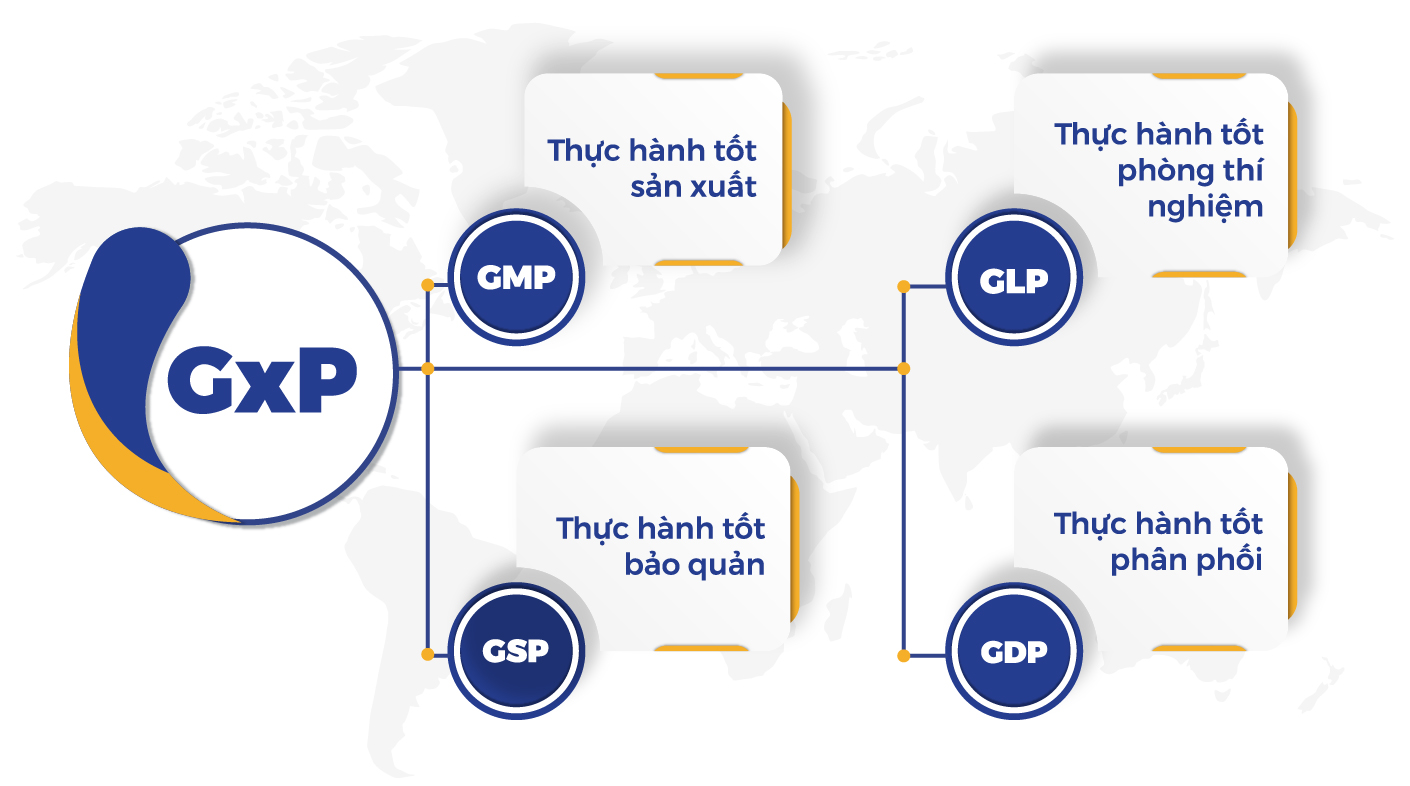
Tiêu chuẩn GMP là gì?
GMP (Good Manufacturing Practices) là bộ tiêu chuẩn thực hành tốt sản xuất nhằm đảm bảo điều kiện vệ sinh an toàn cho sản xuất. Nó bao gồm những nguyên tắc, quy định, hướng dẫn xoay quanh nhà máy và trang thiết bị, việc đào tạo và vệ sinh cá nhân của nhân viên; được áp dụng tại các cơ sở sản xuất, gia công, đóng gói dược phẩm, thực phẩm, thiết bị y tế và mỹ phẩm.
Giấy chứng nhận cơ sở đủ điều kiện an toàn sản xuất thuốc, nguyên liệu làm thuốc, gọi tắt là Giấy chứng nhận GMP sẽ được Cục Quản lý Dược – Bộ Y tế cấp cho các cơ sở sản xuất đạt yêu cầu tiêu chuẩn Thực hành tốt sản xuất.
Bộ hồ sơ tiêu chuẩn GMP mới nhất 2023
Khi có nhu cầu đăng ký cấp giấy chứng nhận GMP, cơ sở sản xuất cần chuẩn bị đầy đủ hồ sơ theo quy định, bao gồm:
– Đơn đề nghị cấp Giấy chứng nhận GMP (theo mẫu);
– Bản sao Giấy đăng ký kinh doanh hoặc các tài liệu pháp lý chứng minh việc thành lập doanh nghiệp như Giấy phép thành lập doanh nghiệp, Giấy chứng nhận đầu tư có chữ ký của chủ doanh nghiệp và đóng dấu xác nhận của doanh nghiệp;
– Bản sao “Chứng chỉ hành nghề dược” của người chịu trách nhiệm chuyên môn;
– Sơ đồ tổ chức của doanh nghiệp;
– Các bản vẽ sơ đồ thể hiện vị trí địa lý, thiết kế của nhà máy như: Sơ đồ mặt bằng tổng thể; Sơ đồ đường đi của công nhân; Sơ đồ đường đi của nguyên liệu, bao bì; Sơ đồ hệ thống cung cấp nước sạch; Sơ đồ cấp khí nhà mát; Sơ đồ xử lý chất thải; Sơ đồ thể hiện cấp độ sạch của phòng sạch nhà máy;
– Tài liệu, chương trình, báo cáo tóm tắt về việc đào tạo thực hành GMP tại cơ sở;
– Đối với cơ sở sản xuất thuốc kiểm soát đặc biệt sẽ cần chuẩn bị thêm bản thuyết trình về phương pháp sản xuất, bảo quản;
Ngoài những tài liệu trên, cơ sở đăng ký cần chuẩn bị thêm các tài liệu khác theo danh mục hồ sơ tổng thể được quy định gồm:
– Thông tin chung về doanh nghiệp: Các thông tin cơ bản, các hoạt động sản xuất được cho phép tại địa bàn
– Hồ sơ quản lý chất lượng: Hệ thống quản lý chất lượng của đơn vị sản xuất; Quy trình xuất xưởng sản phẩm; Quản lý các nhà cung cấp và hợp đồng; Quản lý nguy cơ về chất lượng; Phương pháp đánh giá chất lượng sản phẩm
– Sơ đồ nhân sự của cơ sở sản xuất
– Hệ thống nhà xưởng, các danh mục trang thiết bị hiện có tại nhà xưởng
– Mô tả hệ thống tài liệu tại cơ sở sản xuất
– Hồ sơ sản xuất: Các dạng sản phẩm được sản xuất; Thẩm định quy trình sản xuất; Nguyên tắc quản lý nguyên vật liệu, lưu trữ bảo quản
– Mô tả chi tiết các hoạt động kiểm tra chất lượng tại nhà máy: các phép thử vật lý, hóa học, sinh học và vi sinh
– Phân phối, khiếu nại sản phẩm không đạt chất lượng và thu hồi
– Mô tả ngắn gọn hệ thống tự thanh tra của nhà máy

Quy trình thủ tục đăng ký cấp giấy chứng nhận GMP mới nhất năm 2023
Sau khi chuẩn bị đầy đủ hồ sơ, cơ sở đăng ký cấp Giấy chứng nhận GMP cần thực hiện quy trình thủ tục đăng ký theo các bước như sau:
Bước 1: Nộp hồ sơ
Cơ sở đăng ký nộp hồ sơ đã chuẩn bị về Cục Quản lý Dược – Bộ Y tế, có trụ sở chính tại 138A Giảng Võ, Ba Đình, Hà Nội.
Bước 2: Tiếp nhận và thẩm định bộ hồ sơ
Sau khi tiếp nhận hồ sơ đăng ký kiểm tra của cơ sở theo quy định, Cục Quản lý dược tiến hành thẩm định hồ sơ (có biên bản thẩm định kèm theo).
Trong quá trình thẩm định, các chuyên gia đánh giá sự phù hợp về quy mô và tính hợp lý của việc triển khai tại cơ sở với các dây chuyền mà cơ sở đăng ký kiểm tra. Việc đánh giá dựa trên các yếu tố: Cấp sạch nhà xưởng; công suất thiết bị, hệ thống; chiều di chuyển của nhân viên, nguyên liệu, bán thành phẩm, thành phẩm; phân công và trình độ của các nhân sự chủ chốt…; Những điểm cần lưu ý trong quá trình kiểm tra bao gồm các nội dung chưa phù hợp hoặc còn nghi ngờ.
Trong vòng 05 ngày làm việc kể từ khi nhận được hồ sơ và phí thẩm định, Cục Quản lý dược có trách nhiệm thông báo cho cơ sở về tình trạng hồ sơ nếu chưa đạt yêu cầu hoặc kế hoạch kiểm tra thực tế.
Bước 3: Tiến hành kiểm tra thực tế tại cơ sở
Trong vòng 20 ngày làm việc kể từ khi thông báo kế hoạch kiểm tra, Đoàn kiểm tra phải tiến hành kiểm tra thực tế tại cơ sở. Các nội dung kiểm tra bao gồm:
– Kiểm tra trực tiếp tại các khu vực sản xuất, khu vực kiểm nghiệm, kho bảo quản nguyên liệu, thành phẩm, bao bì, các hệ thống phụ trợ
– Kiểm tra và rà soát hồ sơ lưu trữ về hoạt động của các cơ sở sản xuất
Bước 4: Xử lý kết quả kiểm tra và cấp Giấy chứng nhận GMP
– Trường hợp 1: Cơ sở được kiểm tra đáp ứng tất cả các nguyên tắc, tiêu chuẩn GMP:
Trong thời gian 05 ngày làm việc kể từ khi kết thúc hoạt động kiểm tra, Cục Quản lý dược sẽ cấp Giấy chứng nhận đạt tiêu chuẩn “Thực hành tốt sản xuất thuốc” cho cơ sở đăng ký.
– Trường hợp 2: Đối với cơ sở được kiểm tra đáp ứng cơ bản nguyên tắc, tiêu chuẩn GMP, còn một số tồn tại nhưng không ảnh hưởng đến chất lượng của sản phẩm và có thể khắc phục được trong thời gian ngắn:
Đoàn kiểm tra sẽ yêu cầu cơ sở được kiểm tra báo cáo khắc phục, sửa chữa. Cơ sở phải khắc phục, sửa chữa các lỗi mà Đoàn kiểm tra đã nêu ra trong biên bản và báo cáo kết quả khắc phục gửi về Cục Quản lý dược.
Trưởng Đoàn kiểm tra tổng hợp, báo cáo Cục trưởng Cục Quản lý dược xem xét để cấp Giấy chứng nhận GMP hoặc Cục Quản lý dược phải có thông báo kết quả chính thức cho cơ sở trong vòng 05 ngày làm việc kể từ khi nhận được báo cáo khắc phục.
Sau 02 tháng kể từ ngày kết thúc việc kiểm tra, nếu cơ sở không gửi báo cáo khắc phục hợp lệ thì cơ sở phải tiến hành nộp hồ sơ đăng ký kiểm tra lại từ đầu.
– Trường hợp 3: Đối với cơ sở được kiểm tra chưa đáp ứng nguyên tắc, tiêu chuẩn GMP:
Cơ sở phải tiến hành khắc phục sửa chữa các lỗi được Đoàn kiểm tra nêu ra trong biên bản. Sau khi tự kiểm tra và đánh giá đạt yêu cầu, cơ sở tiến hành nộp hồ sơ lại từ đầu.
Bước 5: Cấp Giấy chứng nhận GMP cho cơ sở đăng ký
Sau khi báo cáo khắc phục được phê duyệt, hồ sơ được hoàn thiện thì doanh nghiệp sẽ được cấp chứng nhận GMP.
Kết luận
Trên đây là những thông tin chi tiết về Quy trình thủ tục đăng ký cấp Giấy chứng nhận GMP và bộ hồ sơ xin cấp Giấy chứng nhận GMP được cập nhật mới nhất năm 2023. Nếu bạn còn bất kỳ thắc mắc nào, vui lòng liên hệ với GMP Groups để được hỗ trợ nhanh chóng:

CÔNG TY CỔ PHẦN GMP GROUPS
Trụ sở: Lô LK20.8, KĐT Sinh thái Ecoriver, phường Hải Tân, thành phố Hải Dương, tỉnh Hải Dương
Hotline/ Zalo: 0945.255.457
Website: gmpgroups.com.vn
Email: info@gmpgroups.com.vn


